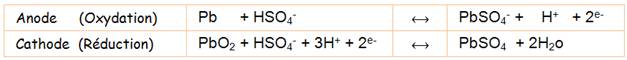|
|||||||||||||||||||||||||||||
![]()
|
BATTERIE Enjeu essentiel pour le développement des voitures
électriques. En 2010, la solution n'est pas encore satisfaisante. Les
recherches sont orientées vers l'autonomie, la diminution du temps de
rechargement, la taille, la sécurité et, bien entendu, le
coût de revient. |
Vocabulaire
|
Batterie: groupement de plusieurs appareils de même type (accumulateurs,
piles, condensateurs, etc.) disposés en série ou en
parallèle. Batterie (électrique): appareil qui transforme l'énergie chimique en électricité
et constitué de plusieurs piles ou d'accumulateurs connectées
en série ou en parallèle. (Série =>
à la queue leu leu; parallèle =>
côte à côte) |
Voir DicoCulture
/ Apocope
|
En 1780, Luigi
Galvani (médecin
italien) étudie l'effet de l'électricité sur les muscles
des animaux (grenouilles). Un scalpel mis en contact avec le nerf provoque la
contraction du muscle, effet renforcé si le scalpel est mis sous
tension électrique. En 1785, Charles
Coulomb expérimente
l'attraction et la répulsion d'objets chargés en électricité.
Il établit la loi qui porte son nom: F = C. q.q'/d²
(similaire à loi de
l'attraction de Newton). Jusque là la source
d'électricité était la bouteille de Leyde, une sorte de condensateur. En 1800, Alessandro
Volta, interprète
différemment les travaux de Tous les laboratoires se mettent
à la fabriquer. Voilà une |
Voir Histoire
de l'électronique
|
|
|
|
Cathode (+) Dioxyde de cobalt Électrolyte Sels de lithium Anode (–) Graphite
Typique
(Ni-Mh) 100
Wh /kg Nickel-hydrure métallique Maximale
existante (Li) 200 Wh /kg Lithium-ion Espoir
? 600
Wh /kg Recherche CNRS Carburant
liquide 10
000 Wh /kg à titre de comparaison
Prise
16 ampères 8
h Prise
32 ampères 5
h
Capacité
totale 26,
5 kWh Capacité
utile 18 kWh |
|
Voir Unités
d'énergie et de puissance
D'après Science et Vie –
Automobile 2010 et l'Express 19/01/2011
|
|
|
|
Type Densité
Densité en
Wh/kg en
Wh/litre Carbone-Zinc 35 90 Plomb 40 100 Ni-Cad 40 140 Ni-Mh 100 300 Alcaline
longue durée 110 320 Lithium-ion 130 230 Lithium-polymère 200 300
100
Wh 1 kg 1 kWh 10 kg 20 kWh 200
kg |
|
|
|
|
|
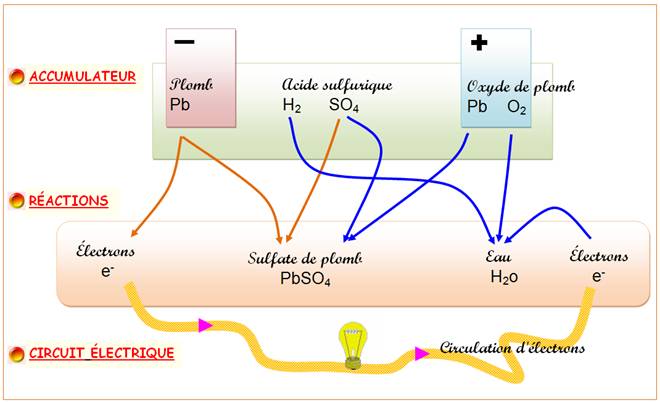
Constitution Électrode négative (anode): plaque remplie de plomb «
spongieux »; Électrode positive (cathode): plaque
contenant une pâte d'oxyde de plomb (dioxyde); Électrolyte: solution diluée d'acide
sulfurique; Séparateurs: feuilles rectangulaires,
placées entre les plaques positives et les plaques négatives. Fonctionnement: Électrode négative: production
d'électrons et d'ions de plomb;
Électrode positive: les
électrons en provenance du circuit avec les ions hydrogène de
l'électrolyte et l'oxyde de plomb forment de
l'eau. Le plomb et l'acide sulfurique forment du
sulfate de plomb. Schéma de principe (simplifié): En bref: le plomb métallique
libère des électrons lorsqu'il réagit avec la solution,
et de l'autre, le dioxyde de plomb en capture.
Note: par convention, le courant
électrique circule du plus vers le moins, soit dans le sens inverse
des électrons. Explications La batterie engendre une circulation
d'électrons – d'électricité – dans le
circuit électrique: ici, une ampoule; dans une voiture, il s'agit du
moteur électrique du démarreur et des accessoires
électriques de la voiture. La batterie au plomb se décharge progressivement dans ce circuit
électrique en "consommant" les électrodes et l'acide
sulfurique pour produire de l'eau et du sulfate de plomb. Une circulation forcée
d'électrons dans l'autre sens – accumulateur branché sur
une source d'électricité – provoque la réaction
inverse et régénère les électrodes et l'électrolyte.
La batterie se charge. Formululation des réactions
chimiques
|
|
Anglais: Lead-acid battery
|
|
|
|
La masse
d'une particule augmente avec la vitesse.
|
|
Sources: Encarta 2003 / Science et Vie –
Août 2011 / Sites Internet
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
![]()
|
Suite |
|
|
Voir |
|
|
Junior |
|
|
DicoNombre |
|
|
Site |
|
|
Cette page |
http://villemin.gerard.free.fr/aScience/Electron/Batterie.htm
|
![]()