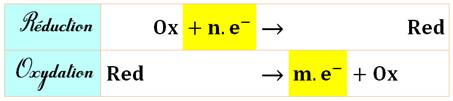|
|||||||||||||||||||||||||||||||||||||||||
![]()
|
Oxydation et Réduction Oxydoréduction Redox Une des réactions chimiques des plus
importantes qui intervient dans la combustion,
la corrosion (rouille, vert de gris
…), la transformation de l'oxygène dans les êtres vivants,
etc. La respiration
cellulaire est une combustion lente et donc une réaction
d'oxydoréduction. Cette réaction par échange d'électrons fait intervenir
à la fois une réduction (départ d'électrons) et
une oxydation (arrivée d'électrons). |
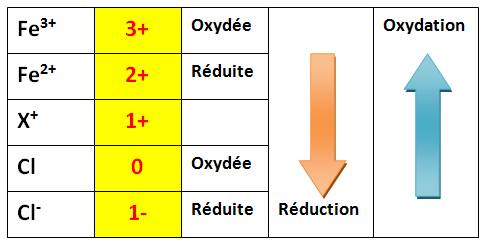
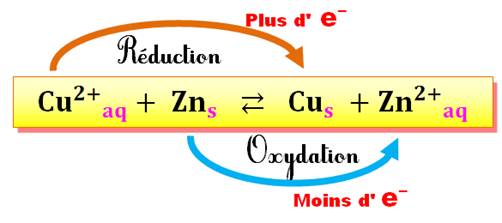
Pour mieux comprendre: suivez le graphique du
bas avec celui du haut.
|
|
||
|
|
Exemple de réaction Redox
|
|
|
|
Équations de réduction et
d'oxydation
|
|
|
|
Équation éclatée deux:
réduction et oxydation
|
|
|
|
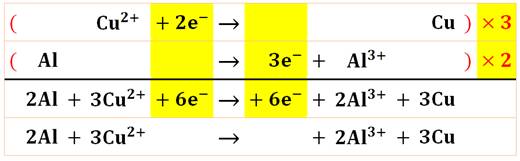
Méthode d'équilibrage de
l'équation
|
|
|
|
|
|
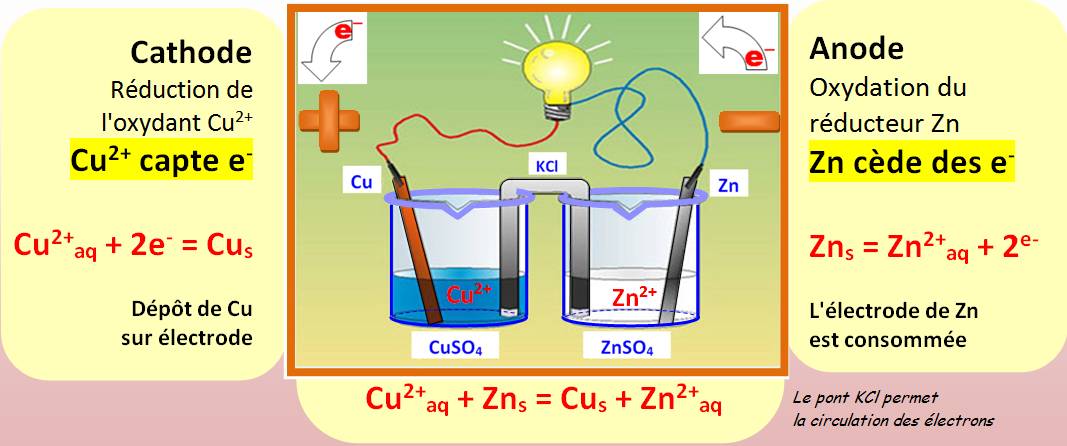
Pile = générateur
électrique formée de:
Source pour la base du
graphique: Les
piles: processus chimiques – CNRS RÉDUCTION à la CATHODE OXYDATION à l' ANODE.
Voir Anode et Cathode Note: Le sens
conventionnel du courant, de la borne
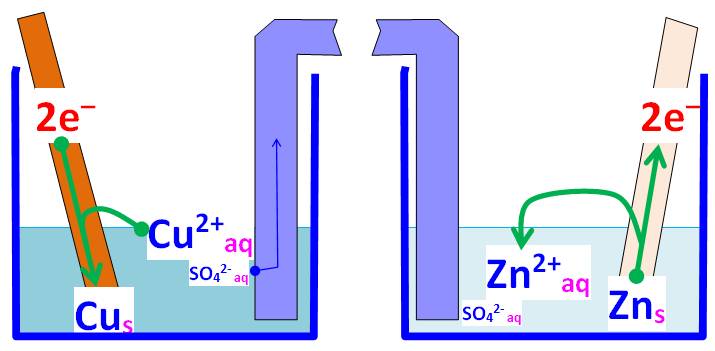
+ vers la borne -, est inverse du sens de propagation des électrons. Ce qui se passe au niveau des électrodes
dans la solution:
|
|
![]()
|
Suite |
|
|
Voir |
|
|
Site |
|
|
Cette page |
http://villemin.gerard.free.fr/aScience/Electron/AnodCath.htm
|
![]()