|
|||||||||||||||||||||||||||||||||||
![]()
|
Liaisons chimiques Les atomes se combinent pour former des composés
chimiques. Quelle est la nature de l'attirance de ces éléments entre eux et
quels sont les types de liaisons mises en place? Il y en a au moins cinq
principales:
Au départ, l'atome est électriquement neutre: autant d'électrons que de protons. Ce sont les électrons des orbitales
externes de l'atome qui vont se lâcher, se dissiper, se marier. |
|
|
|
|
|
|
Voir Histoire
des découvertes et inventions
Règle de l'octet
|
La
couche périphérique d'un atome
(couche orbitale externe) est limitée à huit électrons. |
|
|
|
|
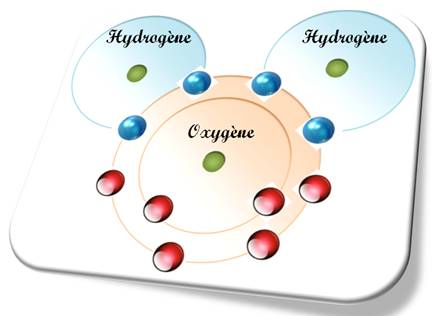
Deux atomes partagent une paire, ou plus,
d'électrons.
Un composé chimique unissant des éléments simples
par liaison covalente sont formellement des molécules.
|
|
Voir Molécules
|
|
|
|
|
|
|
|
|
|
|
|
Liaisons secondaires
|
À
côté des forces assurant la cohésion des atomes à l'intérieur d'une molécule,
il existe des forces secondaires qui
s'exercent soit entre molécules, soit à l'intérieur des molécules, entre
atomes non-directement liés. |
|
|
|
|
|
|
Voir
Siphon et
liaisons hydrogène
|
|
|
|
Johannes Diderik van der Waals (1837-1923) Physicien
néerlandais.
|
|
Bilan
|
Nous
avons un petit aperçu de la nature des liaisons chimiques et des forces de
cohésion qui maintiennent les atomes et les molécules en place. La nature est
essentiellement vide. C'est la répulsion des électrons qui donne du volume et
nous permet de toucher des objets sans les pénétrer ou les casser. La
modélisation (équation de Schrödinger) n'a pas forcément de solutions
simples. En fait, les électrons sont plutôt des fonctions d'onde décrivant
des orbitales probables. Les équations sont rarement
intégrables. La parfaite maîtrise des liaisons chimiques laisse encore de
beaux calculs en perspectives pour les physiciens. Malgré
cela, le modèle donne des résultats si bons qu'il ne peut pas ne pas
correspondre à une vérité sous-jacente. |
Inspiré des livres cités en référence et de recherches Internet
![]()
|
Suite |
|
|
Voir |
|
|
|
|
|
Cette page |
http://villemin.gerard.free.fr/aScience/Chimie/aaaExpli/Forces.htm |
![]()